Лекарственные препараты
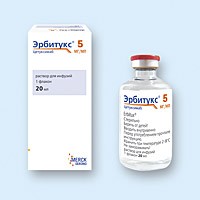
Эрбитукс (erbitux) р-р инф. 2 мг/мл фл. 50 мл, № 1
| Код товара | 8814 | |
| Производитель | Мерк,Германия | |
| Лек. группа: | Лекарственные средства | |
| Цена: | Н.д. | Уточнить цену |
Инструкция и описание Эрбитукс (erbitux) р-р инф. 2 мг/мл фл. 50 мл, № 1:
ЭРБИТУКС (ERBITUX) CETUXIMABUM L01X C06 Merck KGaA СОСТАВ И ФОРМА ВЫПУСКА: р-р инф. 2 мг/мл фл. 50 мл, № 1 Цетуксимаб 2 мг/мл ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА: цетуксимаб представляет собой химерное моноклональне антитело IgGl, направленное против рецептора эпидермального фактора роста (РЭФР). Сигнальные пути РЭФР контролируют выживание клетки, развитие клеточного цикла, ангиогенез, миграцию клеток и клеточные инвазии/метастазы. Цетуксимаб связывается с РЭФР с афинностью, приблизительно в 5–10 раз превышающую характерную для эндогенных лигандов. Цетуксимаб блокирует связывание эндогенных лигандов РЭФР, что приводит к ингибированию функций рецепторов. Далее он индуцирует интернализацию РЭФР, что может приводить к отрицательной регуляции рецептора. Цетуксимаб также сенсибилизирует цитотоксические иммунные эффекторные клетки по отношению к экспрессирующим РЭФР опухолевым клекам (зависимая от антител клеточно-опосредованная цитотоксичность (ЗАКЦ)). Фармакодинамические эффекты В опытах in vitro и in vivo цетуксимаб ингибирует пролиферацию и индуцирует апоптоз опухолевых клеток человека, которые експрессируют РЭФР. In vitro цетуксимаб ингибирует продукцию ангиогенных факторов в опухолевых клетках и блокирует миграцию эндотелиальных клеток. In vivo цетуксимаб ингибирует продукцию ангиогенных факторов в опухолевых клетках и снижает активность неоваскуляризации и метастазирования опухолей. Иммуногенность Появление антихимерных антител у человека (ЧАХА) является результатом действия класса химерных антител. Современные данные по продуцированию ЧАХА ограничены. В целом измеренные титры ЧАХА оказываются у 4,9% наблюдаемых больных с частотами от 0% до 8,5% в опытах с подобными показаниями. На сегодня отсутствуют четкие данные о нейтрализующем действии ЧАХА на цетуксимаб. Появление ЧАХА не коррелирует с развитием реакции гиперчувствительности или другими нежелательными эффектами цетуксимаба. Фармакокинетика Фармакокинетика цетуксимаба была изучена в клинических исследованиях при назначении препарата в форме монотерапии или комбинации с сопутствующей химиотерапией или радиационной терапией. В/в инфузии цетуксимаба продемонстрировали дозозависимую фармакокинетику при еженедельном введении препарата в дозе от 5 до 500 мг/м2 п лощади поверхности тела. При назначении цетуксимаба в начальной дозе 400 мг/м2 п лощади поверхности тела средний объем распределения был приблизительно эквивалентным сосудистому участку (2,9 л/м2 в диапазоне 1,5–6,2 л/м2). Среднее значение максимальной концентрации (± стандартное отклонение) составляло 185 + 55 мкг/мл. Средний клиренс равнялся соответственно 0,022 л/г/м2 п лощади поверхности тела. Период полувыведения цетуксимаба длительный с изменением значений в диапазоне 70–100 ч в указанной дозе. Сывороточные концентрации цетуксимаба достигали стабильных значений через 3 нед монотерапевтического применения препарата. Среднее значение максимума концентрации составляло 155,8 мкг/мл через 3 нед и 151,6 мкг/мл через 8 нед, в тот же время соответствующее среднее значение сниженых концентраций составляло 41,3 и 55,4 мкг/мл, соответственно. В исследованиях по комбинированному назначению цетуксимаба с иринотеканом среднее значение снижения концентрации соответствовало 50 мкг/мл через 12 нед и 49,4 мкг/мл через 36 нед. Описано несколько путей метаболизма антител. Все эти пути включают биодеградацию антител до более мелких молекул, т.е. низкомолекулярных пептидов и аминокислот. Фармакокинетика у разных групп пациентов Объединенный анализ всех клинических исследований показал, что фармакокинетические характеристики цетуксимаба не зависят от расы, пола, возраста и состояния функции почек и печени пациента. На данное время в проведенных исследованиях принимали участие только больные с адекватным уровнем функционирования почек и печени (уровень креатинина сыворотки крови не более чем в 1,5 раза, трансаминаз — в 5 раз и билирубин — в 1,5 раза превышал верхнюю границу нормы). Доклинические данные по безопасности В исследованиях по изучению токсичности хронического введения препарата у обезьян Циномолгус на значимом клиническом уровне основным зарегистрированным проявлением была кожная токсичность. Цетуксимаб вызвал у обезьян тяжелые токсические кожные и летальные осложнения при концентрации в 17 раз выше, чем у человека при использовании стандартных режимов терапии. Доклинические данные генотоксичности и местной переносимости, полученные при случайном введении препарата другим способом, а не путем инфузии, не показывают существования угрозы для человека. Не проводилось практических исследований на животных по оценке канцерогенного потенциала цетуксимаба, выявления его влияния на репродуктивную функцию самцов и самок или его тератогенного потенциала. Токсикологические исследования при одновременном назначении цетуксимабаа и иринотекана также не проводились. На сегодня отсутствуют доклинические данные по влиянию анти-РЭФР антител на процесс заживления ран. Хотя на доклинических моделях регенерирующих ран, было показано, что РЭФР-селективные ингибиторы тирозинкиназы увеличивают продолжительность заживления ран. ПОКАЗАНИЯ: препарат Эрбитукс в комбинации с иринотеканом назначают для лечения больных с метастатическим раком прямой и ободочной кишки, у которых цитотоксическая терапия иринотеканом была безуспешной. Эрбитукс в комбинации с лучевой терапией показан для лечения локальных форм сквамозного рака кожи головы и шеи. ПРИМЕНЕНИЕ: рекомендуется выполнять анализ экспрессии РЭФР в лаборатории, имеющей соответствующий опыт, с использованием достоверных методов тестирования. Эрбитукс следует назначать под наблюдением врача, имеющего опыт использования антинеопластических лекарственных препаратов. Во время инфузии и на протяжении как минимум 1 ч после нее необходимо проводить строгий контроль состояния больного. Должена быть гарантирована возможность в случае необходимости использования реанимационного оборудования. Перед первым вливанием пациентам следует назначить премедикацию антигистаминными препаратами. Подобная премедикация рекомендована перед каждой последующей инфузией. Эрбитукс назначают 1 раз в нед. Первая доза составляет 400 мг цетуксимаба на м2 п оверхности тела. В дальнейшем еженедельная доза — 250 мг/м2. Для первой дозы рекомендованный период вливания составляет 120 мин. Для последующих еженедельных доз рекомендованная продолжительность вливания — 60 мин. Максимальная скорость инфузии не должна превышать 10 мг/мин, что эквивалентно 5 мл/мин Эрбитукса 2 мг/мл. Колоректальный рак Для лечения метаститического колоректального рака Эрбитукс используют в качестве монотерапии, а также в комбинации с иринотеканом. Для определения дозы иринотекана, при их одновременном назначении, нужно обращаться к информации о данном лекарственном препарате. Как правило, используется такая же доза иринотекана, которая назначалась в последних циклах предыдущего курса терапии, содержащей иринотекан. Однако следует соблюдать рекомендации по модификации доз иринотекана, изложенных в информации об этом лекарственном препарате. Иринотекан нельзя назначать ранее, чем через 1 ч после окончания инфузии цетуксимаба. Рекомендуется продолжать лечение Эрбитуксом до регистрации прогрессирования основного заболевания. Эрбитукс вводится в/в через линию фильтрации с использованием инфузионного насоса, гравитационной капельной системы или шприцевого насоса. Для первой дозы рекомендованный период вливания составляет 120 мин. Для последующих еженедельных доз рекомендованная продолжительность вливания — 60 мин. Максимальная скорость инфузии не должна превышать 5 мл/мин. Сквамозный рак кожи головы и шеи Препарат Эрбитукс назначается при лечении локальных форм сквамозного рака кожи головы и шеи в комбинации с лучевой терапией. Рекомендуется назначать терапию Эрбитуксом за неделю до начала лучевой терапии и продолжать до конца лучевой терапии. Для лечения рецидивирующего и/или метастаирующего сквамозного рака головы и кожи Эрбитукс используют в качестве монотерапии. Рекомендуется продолжать лечение Эрбитуксом до регистрации прогрессирования основного заболевания. Инструкция по использованию и обращению с препаратом Эрбитукс можно вводить с помощью гравитационной кпельницы, инфузионного насоса или шприцевого поршня. Для вливания необходимо использовать отдельную инфузионную линию, а в конце вливания линию необходимо промыть стерильным р-ром хлорида натрия 9 мг/мл (0,9%) для инъекций. Эрбитукс представляет собой бесцветный р-р, который может содержать беловатые аморфные частички препарата. Эти частички не влияют на качество препарата. Тем не менее, р-р необходимо профильтровать через внутренний фильтр линии с размером пор 0,2 мкм или 0,22 мкм во время введения препарата. Эрбитукс совместим с: полиэтиленовыми, этилвинилацетатными или поливинилхлоридными сумками; полиэтиленовыми, этилвинилацетатными или поливинилхлоридными, полибутадиеновыми или полиуретановыми инфузионными наборами; полиэтерсульфоновыми, полиамидными или полисульфоновыми фильтрами линий. При подготовке вливания особую осторожность следует соблюдать для поддержания асептических условий. Эрбитукс необходимо готовить следующим образом: Фильтрация в линии с инфузионным насосом или гравитационной капельницей: взять стерильный шприц (минимум 50 мл) и надеть на него иглу. Отобрать необходимое количество цетуксимаба из флакона. Перенести цетуксимаб в стерильный контейнер или сумку, в которой создан вакуум. Повторить процедуру до получения рассчитанного объема. Установить соответствующий линейный фильтр в инфузионную линию и смочить его Эрбитуксом перед началом вливания. Использовать для введения гравитационную капельницу или инфузионный насос. Установить и контролировать скорость введения в зависимости от указаний. Фильтрация в линии со шприцевым насосом : возять стерильный шприц (минимум 50 мл) и надеть на него иглу. Отобрать необходимое количество цетуксимаба из флакона. Снять иглу и установить шприц в шприцевый насос. Взять соответствующий линейный фильтр и присоединить его к набору для вливания. Присоединить инфузионную линию к шприцу. Установить и контролировать скорость введения в соответствии с указаниями и начинать вливание после смачивания линии Эрбитуксом. Повторите эту процедуру до полного вливания всего рассчитанного объема. Фильтры могут закупориваться во время инфузии. Если очевидно, что фильтр забился, его необходимо заменить. Химическая и биохимическая стабильность р-ра в применении была продемонстрирована в течение 20 ч при температуре 25°С. Эрбитукс не содержит антибактериальных консервантов или бактериостатических компонентов. С микробиологической точки зрения, данный препарат нужно использовать немедленно после вскрытия флакона. Если препарат не был использован сразу, время и условия хранения готового к применению препарата зависят от пользователя и, в норме, не должны превышать 24 ч при температуре 2–8°С, за исключением случаев, когда вскрытие упаковки (флакона) проводится в контролируемых и стабильных асептических условиях. ПРОТИВОПОКАЗАНИЯ: пациентам с известной тяжелой (III или IV степени) гиперчувствительностью к цетуксимабу. ПОБОЧНЫЕ ЭФФЕКТЫ: побочные эффекты, описанные в данном разделе, относятся к цетуксимабу. Данные о том, что иринотекан влияет на профиль безопасности цетуксимаба и наоборот, отсутствуют. При комбинированном применении с иринотеканом побочные эффекты дополнялись таковыми, которые являются ожидаемыми при назначении иринотекана (такие как диарея 72%, тошнота 55%, рвота 41%, мукозиты, т.е. стоматиты 26%, лихорадка 33%, лейкопения 25%, облысение 22%). Таким образом, также следует ознакомиться с информацией о лекарственном веществе иринотекан. Клинически значимых отличий побочных эффектов в зависимости от половой принадлежности не выявленно. В комбинации с местной лучевой терапией головы и шеи дополнительно отмечаются побочные эффекты, характерные для лучевой терапии (стоматиты, лучевые дерматиты, дисфагия, лейкопения, в основном —лимфоцитопения). В рандомизированных клинических исследованиях при участии 424 пациентов отмечались несколько чаще мукозиты и лучевые дерматиты, чем у пациентов, которые получали только лучевую терапию. Диспноэ может развиться в течение короткого периода времени после введения цетуксимаба, как часть реакции гиперчувствительности, но подобные случаи также описывались и после нескольких недель терапии, что, вероятно, было связано с основным заболеванием. Риск возникновения тяжелого и продолжительного диспноэ, существует для больных пожилого возраста со сниженным функциональным статусом дыхательной системы и бронхо-легочными заболеваниями в анамнезе. Если у больного развивается диспноэ во время курса применения цетуксимаба, рекомендуется провести обследование с целью выявления признаков прогрессирующего заболевания легких. Были описаны частные случаи интерстициальных легочных заболеваний, связь которых с применением цетуксимаба не была установлена. Кожные реакции Если у больного появляются тяжелые кожные реакции (3 степень; Национальный институт рака в США — общие критерии токсичности, NCI-CTC), применение цетуксимаба необходимо прекратить. Возобновление терапии допускается только в случае снижения реакции до II степени. Если тяжелые кожные реакции возникают впервые, лечение можно возобновить без изменения уровня дозы. При вторичном или третичном развитии тяжелых кожных реакций применение цетуксимаба снова необходимо прервать. Терапию можно возобновить на более низком дозовом уровне (200 мг/м2 п оверхности тела после второго возникновения реакции и 150 мг/м2 — после третьего), в том случае, если реакция снизилась до II степени. Если тяжелые кожные реакции развиваются в четвертый раз или не снижаются до II степени, необходимо окончательно прекратить терапию цетуксимабом. До настоящего времени были исследованы только больные с адекватным уровнем функционирования почек и печени (уровень креатинина сыворотки крови не более чем в 1,5 раза, трансаминаз — в 5 и билирубин — в 1,5 раза превышал верхнюю границу нормы). Применение цетуксимаба не изучалось у больных со следующими отклонениями гематологических показателей (одним или больше): гемоглобин ≤ 9 г/дл; число лейкоцитов ≤ 3000/мм3; абсолютное число нейтрофилов ≤ 1500/мм3; число тромбоцитов ≤ 100 000/мм3. Нарушения со стороны иммунной системы Частые (1/100, ≤1/10) Приблизительно у 5% больных во время применения цетуксимаба развивались реакции гиперчувствительности; приблизительно половина этих реакций были тяжелыми. Легкие или умеренные реакции (1 или 2 степени) включают такие симптомы, как лихорадка, озноб, тошнота, кожная сыпь или диспноэ. Тяжелые реакции гиперчувствительности (3 или 4 степени) как правило развиваются во время первой инфузии цетуксимаба или в течение 1 ч после нее. Их симптомы включают быстрое развитие обструкции дыхательных путей (бронхоспазм, стридор, хрипота, затруднение при разговоре), появление уртикарной сыпи и/или гипотензии. Нарушение со стороны глаз Частые (1/10) Развитие конъюнктивитов можно ожидать приблизительно у 5% больных. Респираторные, торакальные и медиастинальные нарушения Очень частые (1/10) Диспноэ описано у 25% больных с последней стадией рака прямой и ободочной кишки. Повышение частоты возникновения диспноэ (иногда тяжелого) наблюдалось у больных пожилого возраста, у пациентов со снижением функционального статуса или хроническими бронхо-легочными заболеваниями в анамнезе. Нарушение со стороны кожи и подкожных тканей Очень частые (1/10) Кожные реакции могут развиваться более чем у 80% пациентов; приблизительно 15% зарегистрированных реакций — тяжелые. Как правило это реакции в форме акнеподобных высыпаний и/или изредка в форме нарушений со стороны ногтей (например паронихия). Большинство кожных реакций развиваются в течение первой недели терапии. Как правило, они исчезают со временем без следствий после прерывания лечения, в случае проведения необходимой коррекции режима дозирования. В соответствии с НОР-ЗКТ, кожные реакции II степени характеризуются высыпаниями, занимающими около 50% поверхности тела, в то время как реакции III степени занимают 50% и более площади поверхности тела. ОСОБЫЕ УКАЗАНИЯ: Реакции гиперчувствительности Если у больного реакции гиперчувствительности легкой или умеренной степени (I или II степень — Национальный институт рака в США — общие критерии токсичности, NCI-CTC), можно уменьшить скорость инфузии. Рекомендуется поддерживать подобную низкую скорость вливания во всех последующих инфузиях. У больных, получающих цетуксимаб, были описаны тяжелые реакции гиперчувствительности (III или IV степени по NCI-CTC). Как правило симптомы появлялись во время первой инфузии и в течение 1 ч после ее окончания, но могли появляться и через несколько часов. Следует предупредить больного о возможности подобной поздней манифестации симптомов и необходимости консультации врача в случае возникновения симптомов гиперчувствительности. При развитии тяжелых реакций гиперчувствительности — немедленно и окончательно прекратить лечение цетуксимабом, в случае необходимости больному следует оказать неотложную медицинскую помощь. До нынешнего времени применение препарата было изучено только у больных с адекватным уровнем функционирования почек и печени. Действие цетуксимаба не исследовали у отдельных больных с ранее диагностированными гематологическими нарушениями. Необходимость оптимизации дозы у пациентов пожилого возраста отсутствует, но опыт применения препарата ограничен в группе лиц в возрасте 75 лет и старше. Особое внимание следует уделять больным со сниженным функциональным резервом и имеющимися легочно-сердечными заболеваниями в анамнезе. Не была изучена безопасность и эффективность цетуксимаба у больных в педиатрической практике. Данные о применении цетуксимаба в комбинации с радиационной терапией при заболевании раком прямой и ободочной кишки ограничены. Период беременности и кормления грудью Рецептор эпидермального фактора роста (РЭФР) включается в развитие плода, а относительно других антител IgGl было установлено, что они проникают через плацентарный барьер. Данные о применении препарата в период беременности и кормления грудью отсутствуют. Рекомендуется назначать цетуксимаб в период беременности только в том случае, если потенциальная польза превышает риск для плода. Женщинам не рекомендуется кормить груддью во время лечения цетуксимабом и на протяжении 1 мес после приема последней дозы, поскольку неизвестно, экскретируется ли цетуксимаб в грудное молоко. Влияние на способность управления автотранспортными средствами Исследования относительно влияния препарата на способность управления техникой не проводились. Если больной отмечает связанные с лечением симптомы, снижающие его способность концентрации внимания и быстроту реакции, рекомендуется отказаться от управления автомобилем и техникой до исчезновения подобных эффектов. ВЗАИМОДЕЙСТВИЯ: данные о том, что иринотекан влияет на профиль безопасности Эрбитукса и наоборот, отсутствуют. Формальные исследования взаимодействия показали, что фармакокинетические характеристики цетуксимаба не меняются при одновременном назначении единичных доз иринотекана (350 мг/м2 п лощади поверхности тела). Также не менялась фармакокинетика иринотекана при одновременном применении цетуксимаба. Другие формальные исследования взаимодействия цетуксимаба у человека не проводились. При отсутствии данных по исследованию совместимости запрещается смешивать данный лекарственный препарат с другими препаратами. Необходимо использовать отдельные линии для парентерального вливания препарата. ПЕРЕДОЗИРОВКА: случаи передозировки не описаны. Однако в настоящее время отсутствует опыт применения единичных доз, превышающих 500 мг/м2 п оверхности тела. УСЛОВИЯ ХРАНЕНИЯ: хранить в холодильнике при температуре от 2–8 °С. Не замораживать. Установлена стабильность препарата Эрбитукс 2 мг/мл после открытия флакона — 20 ч при температуре 25 °С. Эрбитукс не содержит антимикробных консервантов и бактериостатических агентов. Рекомендуется использовать препарат немедленно после открытия флакона. В случае неиспользования препарата немедленно после открытия допускается хранение на протяжении не более 24 ч при температуре от 2–8 °С (на усмотрение потребителя). Срок годности — 2 года.